一、操作流程:
(一)工作液体配制:
1)Fluo-4工作液配制:
每管Fluo-4 AM:+8μlDMSO +2μlF-127
2)Fluo-4工作液使用(0.5-5uM)
储液稀释1000倍使用(倍稀释数可根据实验调节):1mlDMEM+1μlFluo-4工作液
3)Fluo-4指示剂孵育:
将培养皿中原培养基弃去,加入500-1000μlFluo-4溶液,37℃孵育20min。
4)清洗:
将Fluo-4溶液弃去,用不含有钙、镁离子的HBSS溶液清洗3遍,每次2-3min,最后加上相应的浴液开始拍摄。
(二)钙离子成像:
将待测样品放在显微镜载物台上观察,通过钙离子检测系统进行实时监测测定。在相同的环境下(同一光学系统、同一温度、恒定的曝光时间等) 激发成像,测定一定时间序列胞内钙离子的荧光强度Ratio 和钙离子浓度的变化。 使用普通荧光显微镜或者激光共聚焦显微镜进行拍摄。
以Leica MI8为例:
采用xyt时间轴拍摄模式:Time interval:3s;Frames:200(根据实验而定)。
1) 开机:先开硬件,再开软件。
开机顺序:按照显微镜电源,LED荧光电源,摄像机电源,电脑电源,依次打开。
2)启动徕卡LAS X软件
! 注意!
请不要在显微镜等相关硬件没有开启的情况下启动软件!
(1) 双击电脑桌面上LAS X图标启动LAS X。

徕卡LAS X 系统开始运行。
使用徕卡LAS X进行图像采集时参数的设置方法。
点击Acquire箭形图标后再点击Acquisition,就可以在Acquisition mode菜单中进行设置了:
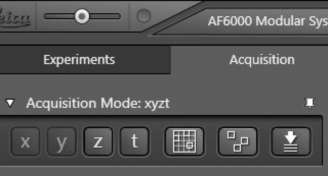
x和y按钮总是处于激活状态。

激活z按钮即可进行三维图像采集的设置。(钙成像不需对z进行设置,勿动。)

激活t按钮即可打开t-菜单,进行时间序列采图的条件设置。
(3)光路设置
光路设置菜单位于LAS X界面的左边。通过该菜单可以对不同实验进行光路设置。
当 图标处于激活状态,就可以开始进行光路设置了。从第一个通道开始:
图标处于激活状态,就可以开始进行光路设置了。从第一个通道开始:
双击 ,从LUT (色彩查找表)中选择对应的颜色
,从LUT (色彩查找表)中选择对应的颜色
从反差方式(Contrast Method)窗口选择您需要的对比方式。在荧光滤色块窗口选择需要的荧光滤色块。
其他通道可以通过点击"+" 按钮来创建,也可以点击"-"按钮删除不需要的通道。如果想要改变通道的顺序,可以点击对应通道右键选择移动(以 FCr 1为例)。
您可以自由定义多达8个通道。且可以点击右键保存您选择的通道的设置。保存的通道在以后的实验还可以调用。
所有通道的组合包括采集参数都可以通过Load/Save Settings菜单来保存并可以从中调用已保存设置。
(4)Image菜单
Image菜单用来设置摄像头相关参数:
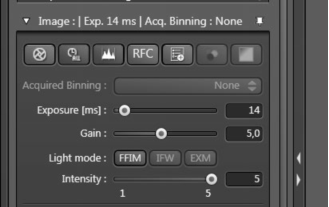
最重要的参数是Binning和Exposure曝光时间。
Binning 是将几个像素加起来作为一个像素读出以提高灵敏度。比如Binning 2x2就是4个像素联合起来 (x方向2个像素*y方向2个像素)。
这会使图像分辨率降低4倍。一般采图会选择Binning 2。
Exposure 曝光时间滑块可以对每个通道的曝光时间分别设置。Gain设置摄像头的电子增益。
Intensity 为照明光路的光强设置。
(5)t-菜单 时间序列采图
点击 ,t-菜单即被激活,可进行时间序列图像采集的设置:
,t-菜单即被激活,可进行时间序列图像采集的设置:
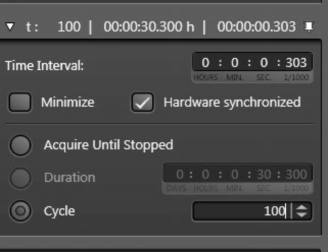
选择Cycle则可定义所需的图像采集帧数。
选择Duration,可定义采图总时间。
选择Acquire until Stopped 则实验没有明确的结束时间,图像将持续采集直至点击stop来终止。
Time Interval(采集相邻两帧图像的时间间隔)可以在输入框中定义(定义的时间间隔大于Minimize值)。
如果Minimize被激活了,则图像采集时会按照最短时间间隔来执行。
(三)、数据图像处理
1)保存软件生成的LIF文件。(非常重要)
2) 在电脑上成像后,建立背景 ROI,计算背景光密度值 Fb 以扣除背景。
3) 通过软件自动识别细胞样品,建立样品 ROI 区域。
4)实时输出细胞的荧光光密度比率变化曲线图和游离 Ca2+的浓度变化曲线图 ,并存储数据。
(四)、关机
关机时先关闭软件再关闭,与开机时顺序相反。
二、注意事项:
1、该仪器应避免灰尘、潮湿、过冷、过热(要求:环境温度10-36℃,湿度≤70%)及酸、碱性蒸汽等;
2、室内不允许存放化学药品,更不得将镜头存放在装有化学药品的容器内;
3、分析完毕,清理现场。显微镜的物镜及目镜光学表面可以使用棉签蘸取无水乙醇清洁。
4、在放置培养板时,轻拿轻放,避免液体溅落在镜头上,万一溅落请立即擦拭干净!
5、使用的给药灌流装置,在实验结束后必须使用过滤过的纯水进行冲洗!!不得少于3遍!
